Авторы: Есжанова А.К., Акимджанова Д.К., Турусбекова Б.Н.
лаборанты, медсестра лаборатории
СПИД ЦЕНТР г.Талдыкорган
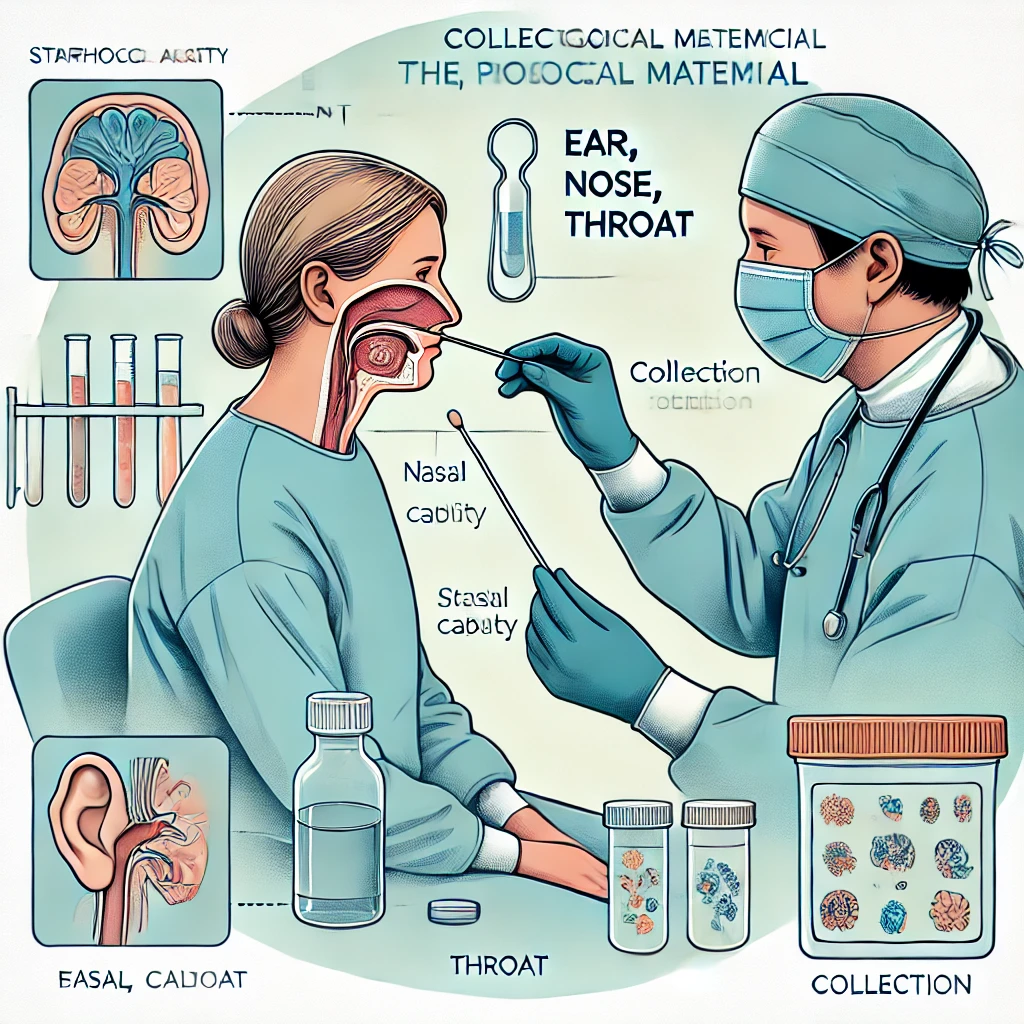
У больных острым и хроническим гнойным гаймороэтмоидитом забор патологического материала из верхнечелюстных пазух осуществляют при пункции их стерильной иглой Куликовского. После пункции пазухи производят аспирацию содержимого. При отсутствии патологического материала вводят стерильный 0,9% раствор натрия хлорида с последующей аспирацией в стерильный шприц.
У пациентов с острым перфоративным гнойным средним отитом и обострением хронического гнойного среднего отита отделяемое из барабанной полости забирают сухим стерильным ватным тампоном при проведении пробы Вальсальвы. Для исключения контаминации тампона сапрофитной микрофлорой кожу наружного слухового прохода необходимо обработать раствором антисептика.
У больных хроническим фарингитом материал со слизистой оболочки ротоглотки забирают стерильным ватным тампоном, увлажнённым стерильным 0,9% раствором натрия хлорида. При хроническом тонзиллите следует осуществлять забор материала непосредственно из лакун нёбных миндалин путём введения стерильного 0,9% раствора натрия хлорида в просвет лакуны с последующей аспирацией содержимого в стерильный шприц.
Материал из полостей фурункулов и абсцессов забирают непосредственно после вскрытия гнойной полости с последующим введением в неё стерильного ватного тампона или путём введения стерильного 0,9% раствора натрия хлорида непосредственно в полость фурункула или абсцесса с последующей аспирацией содержимого в стерильный шприц. При этом необходимо помнить о том, что гной содержит большое количество протеолитических ферментов, разрушающих структуры микроорганизмов, и, по возможности, забирать для исследования не само гнойное отделяемое, а смыв или соскоб со стенок полости фурункула или абсцесса.
Сразу после забора патологический материал из пазух или ватный тампон погружают в 5 мл стерильного сердечно-мозгового бульона (BHI, BBL, USA), в котором его транспортируют в бактериологическую лабораторию. Время от забора материала до доставки в лабораторию должно составлять не более 40 мин.
Далее в условиях лаборатории должна быть проведена предварительная инкубация в термостате при температуре 37 °С в течение 3 ч и затем рассев на плотные питательные среды: BHI-arap (BBL, USA) с 5% крови, среду Endo (BBL, USA), Staphylococcus agar (BBL, USA), Columbia agar base (OXOID, England) с 5% крови, налидиксовой кислотой (15 мг/л), колистином (10 мг/л), Cetrimid agar (BBL, USA), Enterococcus agar (bio Merieux, France), Sabouraud Dextrose agar (bio Merieux, France) с добавлением хлорамфеникола.
Посевы инкубируют в термостате при температуре 37 °С в течение 24-48 ч. Чашки со средой Sabouraud Dextrose agar инкубируют до 3 сут.
Выросшие колонии микроорганизмов изучают макрои микроскопически, подсчитывают количество колоний каждого типа. На следующем этапе выделяют собственно чистую культуру микроорганизмов на скошенном агаре или среде BHI.